針對I類醫療器械制造商的MDCG指南
I類醫療器械制造商的MDCG指南
歐盟委員會的咨詢機構醫療器械協調小組(MDCG)已向最初于2019年12月發布的I類醫療器械制造商發布了指導說明的第一版;特別是,該文件旨在為醫療器械制造商提供以及涉及在MDR推遲的情況下遵守適用法規的建議的其他各方。
本MDCG指南針對打算在歐盟內銷售其產品的I類醫療設備制造商,該文檔中提供的建議也可以由參與醫療器械運營的其他各方使用,包括但不限于打算進入歐盟市場的外國醫療器械制造商的進口商,分銷商和授權代表。MDCG還強調,該文件并不構成對新的《 2017/745醫療器械法規》的明確解釋–該文檔包含的建議不具有約束力且不可執行。

MDCG指出,MDR的范圍實際上比以前由MDR取代的醫療器械指令所涵蓋的范圍更大,因為它涵蓋了醫療器械制造商和其他參與供應鏈的實體。從特定于設備的角度來看,新法規的范圍還涵蓋了不是醫療器械但打算在適當情況下使用的產品(例如,用于醫療器械的清潔,消毒或滅菌)。
MDR下的醫療器械制造商義務
根據MDR,為了允許其銷售醫療器械,制造商應:
證明符合MDR并符合適用的安全和性能要求, 貼上CE標志,提交合格聲明。
為了涵蓋上述幾點,制造商應:
1.實施質量管理體系和風險管理體系;
2.進行臨床評估,進行合格評定(對于無菌醫療設備,具有測量功能的設備或可重復使用的手術器械應包括認證機構);
3.準備根據要求提供的技術文檔, 準備一份歐盟符合性聲明;
4.在電子系統(Eudamed)中注冊為實體,并獲得用于后續通信的單一注冊號(SRN),在Eudamed系統中注冊有問題的設備,然后分配基本UDI-DI。
5.將UDI分配給設備本身及其包裝,以便可以在設備生命周期內使用UDI識別和跟蹤設備。
![]()
6.隨設備一起提供信息,以識別制造商。設備隨附的信息還應涵蓋最重要的安全性和性能方面,并應以歐盟的官方語言提供(取決于要銷售該醫療設備的特定成員國)。
7.建立與基于風險分類的醫療器械類別相對應的適當的售后監督系統(作為質量管理體系的組成部分)。
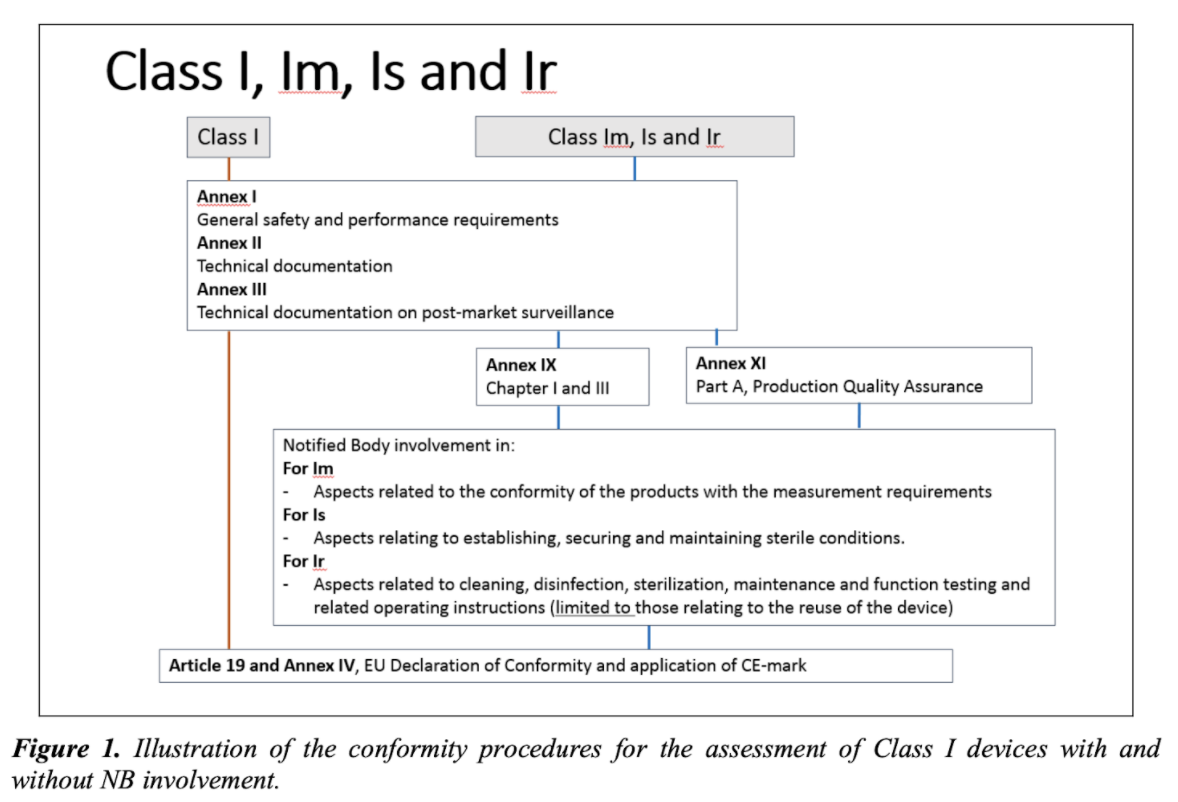
將I類醫療設備投放到歐盟市場
MDCG指南描述了醫療設備制造商將其設備投放到歐洲市場時要執行的程序,整個過程包括一組強制性步驟,即:
1.MDR集成在質量管理系統(QMS)中,MDR中規定的要求應適當地集成到制造商建立的QMS中。
2.確認所涉及的產品是醫療設備,因此應根據MDR進行管理;該確定應基于制造商指示的預期醫療目的進行。
3.確認要檢查的醫療設備是I類醫療設備,初始分類應由醫療設備制造商執行;但是,如有任何疑問,應由監管機構做出最終決定;如果由于其功能而使該設備屬于多個分類規則的范圍,則應使用級別最高的設備。

4.銷售設備之前要執行的程序(風險管理系統的實施,臨床評估,技術文檔的準備,使用和標記的說明以及要求公告機構參與(如果適用))。
5.檢查對制造商的一般義務的合規性(包括合規性策略)。
6.起草歐盟合格聲明。該聲明應包含根據MDR要求在有關醫療器械上的所有信息,并應提供給主管當局。
7.貼上CE認證,表明該醫療設備符合適用的安全和性能要求,并允許在歐盟銷售。對于需要指定機構參與的設備,CE標記應附有進行合格評定的指定機構的編號。
總結以上提供的信息,MDCG指南描述了將I類醫療設備投放到歐盟市場的方式。該指南的范圍還包括無菌醫療器械(Is類),具有測量功能的器械(Im類)以及可重復使用的手術器械(Ir類)–要求公告機構參與上市前的醫療器械類型程序。









